Brennstoffzellen
Der intensive Entwicklungsaufwand für Brennstoffzellen seit Ende der 80er-Jahre liegt unter anderem darin begründet, dass die Brennstoffzelle als emissionsarme und effiziente Energieversorgung in vielen Anwendungsbereichen interessant ist. Neben dem stationären spielt der mobile Anwendungsbereich eine große Rolle, wobei eine wesentliche Triebfeder die Automobilindustrie ist. Seit einigen Jahren werden stationäre Kleingeräte zur Strom- und Wärmeversorgung auch für von Wohngebäude hergestellt. Die jüngere Gerätegeneration hat auch einen deutlich geringeren Platzbedarf.
Aufbau
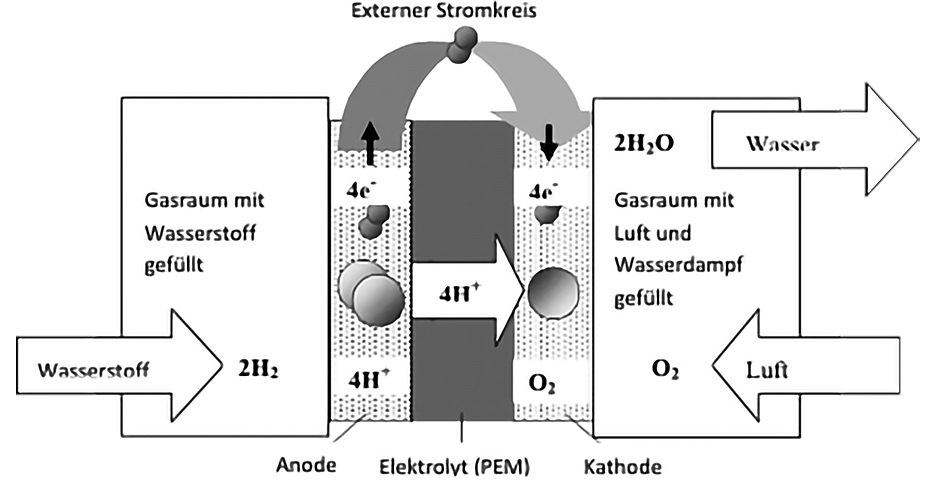
Eine Brennstoffzelle besteht aus zwei voneinander getrennten Gasräumen, in denen Elektroden angeordnet sind, die als Kontaktstelle für den Elektronenfluss dienen. Die Elektroden sind meist katalytisch beschichtet, um die jeweils ablaufende Reaktion zu ermöglichen. Die Elektroden werden als Anode und Kathode bezeichnet. Die Trennung der Gasräume und der Elektroden erfolgt durch den Elektrolyt. Der Elektrolyt ist wesentlich für die Funktion der Brennstoffzelle verantwortlich. Der Elektrolyt erfüllt die Aufgabe einer Membran, wobei eine Überführung der positiv geladenen Wasserstoff-Ionen H+ ermöglicht werden soll. Im Gegensatz dazu muss der Elektrolyt für die eingesetzten Gase Wasserstoff und Sauerstoff undurchlässig sein. Art und Aufbau der Membran unterscheidet verschiedene Brennstoffzellentypen. Der Elektronenfluss findet über einen externen Stromkreis statt.

Funktionsprinzip
Das Wirkungsprinzip der Brennstoffzelle wurde bereits 1839 von Sir William Grove beschrieben.
Im Unterschied zur Strombereitstellung mittels thermischer Prozesse und eines Generators wandeln Brennstoffzellen die chemische Energie eines Brennstoffes in einer Reaktion direkt in elektrische Energie um.
Wasserstoff und Luft werden getrennt jeweils einem Gasraum der Brennstoffzelle zugeführt. An der Elektrode auf der Seite des Wasserstoffes bewirkt der Elektrolyt, dass sich die Elektronen e– und die positiv geladenen Wasserstoff-Ionen H+ abtrennen. Die Elektronen werden von der Elektrode aufgenommen. Diese Elektrode ist wegen des Elektronenüberschusses negativ geladen und wird Anode genannt. Die Oxidation an der Anode findet gemäß folgender Gleichung statt:

Der positiv geladene Wasserstoff H+ wandert durch den Elektrolyten hindurch und verbindet sich an der Kathode mit dem Sauerstoff zu Wasser. Dem so entstandenen Wassermolekül fehlt damit ein Elektron, wodurch zwischen Anode und Kathode eine elektrische Spannung entsteht. Wird ein Stromverbraucher an den beiden Elektroden angeschlossen, so fließt ein elektrischer Strom. Die Elektronen gelangen so über den externen Stromkreis zur Kathode. An der Kathode findet dann die Reduktion statt:

Die Gesamtreaktion (auch Redoxreaktion) ergibt demnach die Vereinigung von Wasserstoff und Sauerstoff zu Wasser und Energieabgabe.
Brennstoffzellen mit einem solchen Aufbau und den beschriebenen Reaktionen heißen Polymer-Elektrolyt-Membran-Fuel-Cells (PEMFC) oder auch Proton-Exchange-Membran (PEM). Die Gesamtreaktion und der externe Elektronenfluss treffen auf alle Brennstoffzellentypen zu. Je nach verwendetem Brennstoff sind die Einzelreaktionen an den beiden Elektroden und die durch den Elektrolyten transportierten Ionen verschieden.
In Tabelle 2 sind die für Mikro-KWK-Anlagen geeigneten Brennstoffzellentypen mit speziellen Eigenschaften und Betriebsdaten zusammengefasst.
PEMFC | PAFC | MCFC | SOFC | |
|---|---|---|---|---|
Bezeichnung | Polymer-Elektrolyt-Membran | Phosphoric Acid Fuel Cell | Molten Carbonate Fuel Cell | Solide Oxid Fuel Cell |
Elektrolyt | Protonleitende Membran | Phosphorsäure | Karbonat-schmelze | Keramischer Festkörper |
Ionenleitung durch | H+ | H+ | CO₃2- | O2- |
Betriebstemperatur | 60–80 °C | 160–220 °C | 600–660 °C | 800–1000 °C |
Nutzbare Wärme | bis ca. 80 °C | bis 120 °C | ca. 400 °C | 450–500 °C |
Interne Reformierung möglich | nein | nein | ja | ja |
Brennstoff zur Zelle | H₂, reformiertes H₂-reiches Gas, Methanol | H₂, reformiertes H₂-reiches Gas, Methanol | H₂, Erdgas, Biogas, Kohlegas | H₂, Erdgas, Biogas, Kohlegas |
Leistungsbereiche | 2 bis 250 kWel | 200 kWel | 250 kWel | 1 bis 10 MWel |
Tabelle 2: Brennstoffzellentypen (Quelle: Pehnt/Traube 2004)
Die Spannung einer einzelnen Brennstoffzelle liegt unter 1 Volt. Um ein Spannungspotenzial von 230 V zu erreichen, müssen etwa 300 Zellen als Brennstoffzellenstapel hintereinandergeschaltet werden. Ein Brennstoffzellenstapel wird auch als Stack bezeichnet.
Vorteile und Nachteile
Gegenüber Verbrennungsmotoren weist die Brennstoffzelle folgende Vorteile und Nachteile auf:
Vorteile | Nachteile |
|---|---|
|
|
Entwicklungsstand
Der Entwicklungsstand von Brennstoffzellenheizgeräte im Leistungsbereich < 50 kWel befindet sich zwischen Pilotstadium und Demonstrationsstadium. Einerseits müssen bei der Brennstoffzellenentwicklung noch funktionelle Fragen, wie zum Beispiel die Materialauswahl von Hochtemperaturbrennstoffzellen, geklärt werden, und andererseits befinden sich bereits über 5.000 Brennstoffzellenheizgeräte weltweit im Demonstrations- und Feldversuch. Zukünftige Herausforderungen der Entwickler sind, die Lebensdauer, den elektrischen Nutzungsgrad und den Gesamtnutzungsgrad zu erhöhen. Entscheidend für den kommerziellen Erfolg ist eine Reduktion der Kosten durch Integration und Systemvereinfachung (Reformer, Wasseraufbereitung, hydraulische Einbindung,…). (Haas et al. 2010)
Teilen — das Material in jedwedem Format oder Medium vervielfältigen und weiterverbreiten.
Der Lizenzgeber kann diese Freiheiten nicht widerrufen, solange Sie sich an die Lizenzbedingungen halten.
Unter folgenden Bedingungen:
Namensnennung — Sie müssen angemessene Urheber- und Rechteangaben machen, einen Link zur Lizenz beifügen und angeben, ob Änderungen vorgenommen wurden. Diese Angaben dürfen in jeder angemessenen Art und Weise gemacht werden, allerdings nicht so, dass der Eindruck entsteht, der Lizenzgeber unterstütze gerade Sie oder Ihre Nutzung besonders.
Nicht kommerziell — Sie dürfen das Material nicht für kommerzielle Zwecke nutzen.
Weitergabe unter gleichen Bedingungen — Wenn Sie das Material remixen, verändern oder anderweitig direkt darauf aufbauen, dürfen Sie Ihre Beiträge nur unter derselben Lizenz wie das Original verbreiten.
Keine weiteren Einschränkungen — Sie dürfen keine zusätzlichen Klauseln oder technische Verfahren einsetzen, die anderen rechtlich irgendetwas untersagen, was die Lizenz erlaubt.
Hinweise zur Namensnennung/Zitierweise:
Texte: Autor_innen des Lernfelds/ Fallbeispiel/ Kurswoche, Erscheinungsjahr, Titel des Lernfelds/ Fallbeispiel/ Kurswoche. Hrsg.: e-genius – Initiative offene Bildung, www.e-genius.at”
Bilder: „Name der Rechteinhaberin/des Rechteinhabers/ Name des Fotografen www.e-genius.at“